Wprowadzenie
Anoda i katoda, to pojęcia stosowane w chemii, fizyce oraz w elektronice. Okazuje się że mamy z tymi pojęciami pewne zamieszanie pod kątem potencjałów elektrycznych anody i katody. Przykładowo dla elektroników anoda to zazwyczaj "plus" a katoda to "minus". W procesach elektrochemicznych "to zależy", np. z punktu widzenia producentów baterii jest dokładnie na odwrót, a przypadku akumulatora zależy od tego czy akumulator jest ładowany czy rozładowywany..
Niniejszy artykuł omawia jaki potencjał elektryczny ma anoda i katoda oraz w jaki sposób zapamiętać kiedy mamy do czynienia z anodą a kiedy z katodą.
Anoda, katoda - etymologia
Terminy anoda i katoda pochodzą z języka greckiego - ἄνοδος (anodos) oznacza wejście na górę a κάθοδος (kathodos) oznacza zejście w dół. Ma to sens z punktu widzenia elektrycznego:
- Potencjał elektryczny anody "wzrasta do góry" - staje się bardziej dodatni.
- Potencjał katody "schodzi z góry" - staje się bardziej ujemny.
Słowa "anoda", "katoda" oraz "jon" zostały wprowadzone do słownictwa naukowego przez Williama Whenwella[1], kiedy współpracował z słynnym Michaelem Faraday’em.
Anoda, katoda - definicja
Najczęściej spotykana definicja anody i katody pochodzi z elektrochemii i jest formułowana w następujący sposób:
- Anoda to elektroda na której zachodzi proces utleniania.
- Katoda to elektroda na które zachodzi proces redukcji.
Utlenianie i redukcja
Niestety większość elektryków i elektroników nie wie (lub nie pamięta), czym jest utlenianie lub redukcja w chemii. Stosując pewne uproszczenie możemy w następujący sposób wyjaśnić te pojęcia:
- Proces utleniania polega na oddawaniu elektronów przez substancję, która jest utleniana. Jeżeli tą substancją jest metal elektrody, który "traci" elektrony, to ładunek tegoż metalu staje się bardziej dodatni czyli "rośnie". Utlenianie metalu podnosi potencjał elektryczny (potencjał "wchodzi na górę") czyli elektroda tego metalu będzie anodą.
- Proces redukcji polega na otrzymywaniu elektronów przez daną substancję. Jeżeli metal elektrody otrzymuje elektrony to jego potencjał elektryczny staje się bardziej ujemy (np. dodatnio naładowany jon metalu zamienia się w neutralny elektrycznie atom). Możemy więc powiedzieć, że potencjał elektryczny metalu elektrody "schodzi w dół", czyli ta elektroda jest katodą.
Wersja dla elektroników
Dla elektryków oraz elektroników będzie łatwiejsza do zapamiętania :) następująca zasada:
Anoda
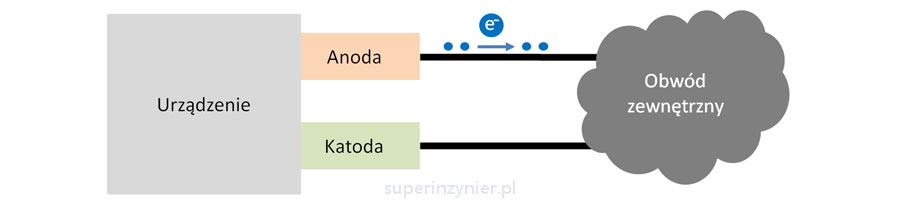
Anoda to elektroda urządzenia, która oddaje elektrony do zewnętrznego obwodu[2]. Elektrony "wypływają z urządzenia przez anodę", więc z powodu ubytku elektronów potencjał elektryczny anody rośnie, staje się bardziej "dodatni".
Katoda
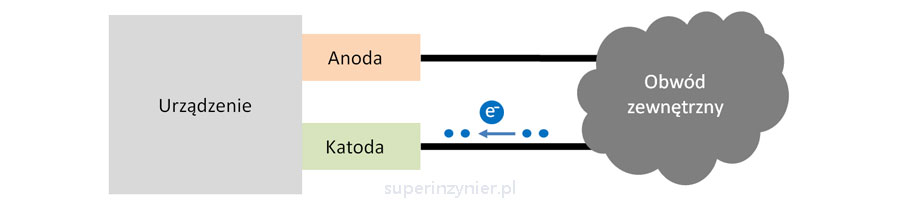
Katoda to elektroda urządzenia, która przyjmuje elektrony od zewnętrznego obwodu[3]. Elektrony "wpływają do urządzenia przez katodę", więc potencjał elektryczny katody staje się bardziej "ujemny".
Anoda i katoda - przykłady
Poniżej zostały omówione przykładowe obwody, gdzie anoda i katoda mają różne potencjały elektryczne. To co zawsze jest stałe, to zasada w której: anoda oddaje elektrony (utlenianie) a katoda przyjmuje elektrony (redukcja). Czyli zasada z definicji jest całkowicie zachowana.
Ogniwo elektrochemiczne
Ogniwo elektrochemiczne (ang. Electrochemical cell) to ogólna nazwa urządzenia, które zawiera dwie elektrody zanurzone w elektrolicie. Ogniwa elektrochemiczne dzielimy na: ogniwa galwaniczne oraz ogniwa elektrolityczne.
Ogniwo galwaniczne
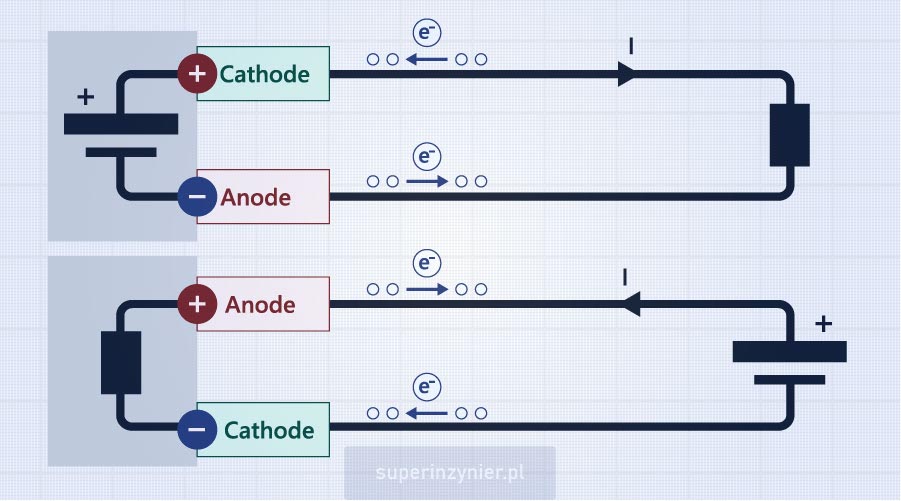
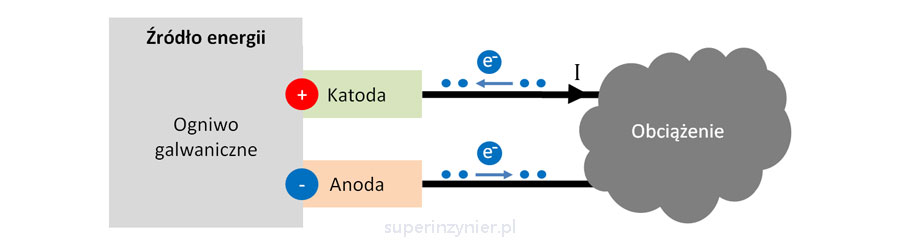
Ogniwo galwaniczne (ang. Galvanic cell) jest źródłem energii elektrycznej. Jest to pojedyncza cela baterii. Jak widzimy na poniższym rysunku, elektrony wypływają z "minusa" ogniwa w kierunku obciążenia i następnie wpływają do "plusa" ogniwa. Elektroda, która przyjmuje elektrony to katoda (+) a elektroda, która oddaje elektrony to anoda (-).
Ogniwo elektrolityczne
Ogniwo elektrolityczne (ang. Electrolytic cell), jest odbiornikiem energii elektrycznej. Przepływ prądu w tym ogniwie jest wymuszony przez zewnętrzne źródło energii. Na poniższym rysunku widzimy, że elektrony ze źródła zasilania (np. baterii) wpływają do elektrody dolnej (-) i następnie wypływają z elektrody górnej (+) w kierunku plusa zasilania. Czyli elektroda dolna "przyjmuje elektrony" i przez to staje się bardziej ujemna (potencjał spada), a elektroda górna "oddaje elektrony" i przez to staje się bardziej dodatnia (potencjał rośnie). Możemy więc stwierdzić, że elektroda górna (+) to anoda a elektroda dolna (-) to katoda.
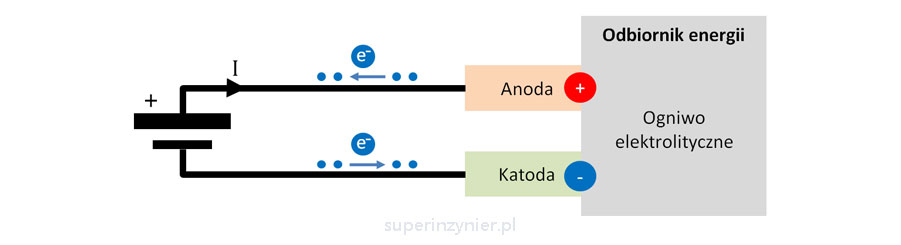
Ogniwa elektrolityczne są stosowane między innymi w procesach galwanizacji. Tą metodą nakładane są niektóre pokrycia styków złącz, aby zredukować ryzyko ich korozji. Powłoki galwaniczne są bardzo popularne i są stosowane w niemal każdym komponencie stosowanym w elektronice.
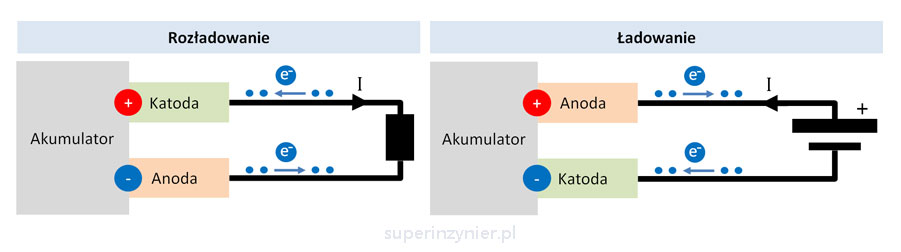
Akumulator
Akumulator to źródło energii elektrycznej tak samo jak bateria. Różnica polega na tym, że akumulator to rodzaj ogniwa galwanicznego, które może być ładowane. W zależności o trybu pracy akumulatora (ładowanie lub rozładowanie) dana elektroda akumulatora jest anodą lub katodą. Poniższy rysunek przedstawia wyprowadzenia akumulatora w czasie ładowania lub rozładowania oraz oznaczono, które wyprowadzenie jest anodą a które katodą.
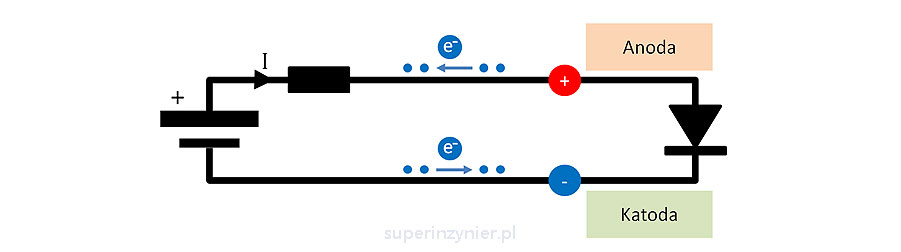
Dioda półprzewodnikowa
Dioda półprzewodnikowa posiada dwa wyprowadzenia: anodę i katodę :). Na poniższym rysunku przedstawiono symbol elektryczny. Katoda to elektroda do której wpływają elektrony w trakcie przewodzenia diody, a anoda to elektroda z której wypływają elektrony (w trakcie przewodzenia). Więc anoda to "plus" a katoda to "minus".
Lampa elektronowa
Lampy elektronowe to szklane bańki z umieszonymi w środku metalowymi elektrodami. W zależności od rodzaju lampy, mamy diody (dwie elektrody - anoda i katoda), triody (3 elektrody), tetrody (4 elektrody), pentody (5 elektrod) itd. W każdej lampie jest katoda i anoda. Dodatkowe elektrody to tzw. siatki (sterujące przepływem elektronów). Zazwyczaj katoda jest podgrzewana (lampa posiada "żarnik"). Lampa elektronowa jest odbiornikiem, więc określenie anoda i katoda ma taki sam sens jak w diodzie półprzewodnikowej.
Lampy elektronowe były popularne przed wprowadzeniem półprzewodników. Obecnie mają zastosowanie w niektórych rozwiązaniach profesjonalnych np. wysokiej klasy wzmacniacze audio.
Lampa kineskopowa
Lampa kineskopowa to w zasadzie duża lampa elektronowa, której anoda to duży ekran pokryty luminoforem. Anoda i katoda jest tak samo rozumiana jak w typowych lampach elektronowych.
Korozja elektrochemiczna
Korozja elektrochemiczna to zjawisko, gdzie mamy do czynienia z przepływem prądu między anodą i katodą w środowisku elektrolitu. Więcej o tym problemie przeczytasz w artykule: Korozja złącz elektrycznych.
Migracja elektrochemiczna
Migracja elektrochemiczna to zjawisko, w którym w zasadzie mamy do czynienia z ogniwem elektrolitycznym. Więcej informacji jest dostępne w artykule: Dendryty i korozja.
Podsumowanie
Anoda i katoda to wyprowadzenia urządzenia, których potencjał elektryczny może być "ujemny" lub "dodatni" w zależności czy dane urządzenie jest źródłem energii czy odbiornikiem energii. Ten aspekt może powodować szereg nieporozumień, czasami bardzo kosztownych.
Określenia anoda i katoda należy stosować ostrożnie, szczególnie w procesach elektrochemicznych. W razie wątpliwości co do oznaczenia elektrod baterii, akumulatorów, ogniw lepiej stosować oznaczenie [+] i [-], albo dokładnie się upewnić, która elektroda to anoda, a która to katoda.
Przypisy
- https://www.britannica.com/biography/William-Whewell
- https://www.britannica.com/technology/anode
- https://www.britannica.com/technology/cathode